Phản ứng nhiệt nhôm là gì?
Phản ứng nhiệt nhôm là 1 loại bội nghịch ứng ở nhiệt độ cao giữa sắt kẽm kim loại nhôm với oxit hoặc với những chất khác. Tất cả vai trò là hóa học khử, phản bội ứng này sinh nhiều nhiệt và tạo thành nhiều 1-1 chất kim loại khác.

Tìm gọi về làm phản ứng sức nóng nhôm
Ta cùng khám phá phản ứng nhiệt nhôm qua phương trình giữa nhôm với các axit như sau:
Nhôm khi phản ứng oxit sắt: 2yAl + 3FexOy → yAl2O3 + 3xFe
Đây là một số loại phản ứng đặc trưng và có nhiều ứng dụng nhất. Ví dụ là hỗn hợp tạo thành gồm bao gồm Fe và Al2O3 dùng làm hàn vá đường tàu lửa.
Bạn đang xem: Hiệu suất phản ứng nhiệt nhôm
Phản ứng sức nóng nhôm sinh ra kim loại nào?
Khi bội nghịch ứng sức nóng nhôm xảy ra, nhôm vẫn đẩy những kim các loại khác thoát ra khỏi oxit bắt buộc thõa mãn điều kiện: Đó phải là những sắt kẽm kim loại trung bình hoặc yếu (từ Zn trở đi). Chúng ta hoàn toàn rất có thể dùng dãy vận động hóa học để bài viết liên quan các kim loại này nếu như vẫn không nhớ.
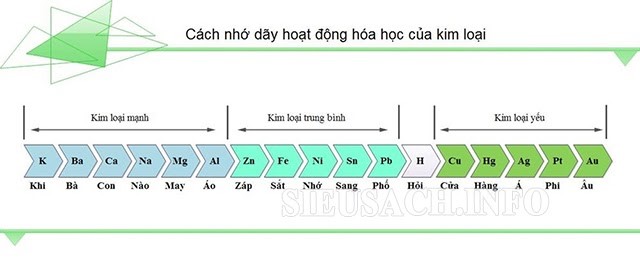
Dãy vận động hóa học sắt kẽm kim loại để bạn tìm hiểu thêm thêm
Lưu ý lúc giải bài tập công suất phản ứng nhiệt độ nhôm
Khi tiến hành giải bài tập này, các bạn học sinh đề xuất phải để ý một số điểm quan trọng đặc biệt dưới đây:
Nếu láo lếu hợp sau thời điểm phản ứng cho công dụng với dung dịch kiềm có sinh ra khí H2 thì Al còn dư sau phản ứng nhiệt độ nhôm hoặc công suất H của bội phản ứng bé thêm hơn 100%. Bội phản ứng này liên quan đến đặc thù của sắt kẽm kim loại Al nên chúng ta học sinh cần được nắm vững.Khi kết thúc phản ứng cơ mà không thấy khí cất cánh lên thì tức là Al ko dư cùng phản ứng thì xảy ra hoàn toànTheo định cơ chế bảo toàn khối lượng, tổng khối lượng hỗn phù hợp trước phản nghịch ứng = tổng cân nặng hỗn hợp sau thời điểm phản ứng.
Một số để ý khi giải bài tập về phản bội ứng nhiệt nhôm
Nhớ vận dụng định chế độ bảo toàn electron khi giải bài xích tập.Giả thiết mang lại phản ứng xảy ra trọn vẹn → Thì chất rắn chắc chắn là có Al2O3, fe hoặc rất có thể có Al, FexOy dư. Còn nếu giả thiết không kể tới hoàn toàn, hoặc bắt tính hiệu xuất thì các bạn nên nhớ đến trường hợp chất rắn sau phản nghịch ứng bao gồm cả 4 chất gồm: Al, FexOy, Al2O3, Fe.
Bài tập về hiệu suất phản ứng nhiệt nhôm bao gồm lời giải
Một số bài tập về phản ứng hiệu suất nhiệt nhôm
Bài số 1:
Đề bàiKhi mang đến 41,4 gam hỗn hợp X gồm gồm Fe2O3, Cr2O3 với Al2O3 công dụng với hỗn hợp NaOH quánh (dư). Sau khoản thời gian phản ứng thu được chất rắn có cân nặng là 16 gam. Để khử hoàn toàn 41,4g X bằng phản ứng nhiệt độ nhôm, buộc phải dùng 10,8 gam Al. Thành phần tỷ lệ theo khối lượng của Cr2O3 tất cả trong tất cả hổn hợp X là? (Cho biết: hiệu suất của các phản ứng là 100%; O = 16; Al = 27; Cr = 52; sắt = 56)
50,67%. 20,33%. 66,67%. 36,71%.Xem thêm: Cách In File Excel Trên Giấy A4, Hướng Dẫn Cách In Excel Trên 1 Trang Giấy A4

Bài tập số 1
Lời giải
Khi cho các thành phần hỗn hợp X công dụng với NaOH ta thu được các phương trình chất hóa học sau đây:
PTHH: Cr2O3 + 2NaOH → 2NaCrO2+ H2O
PTHH: Al2O3 + 2NaOH → 2NaAlO2 + H2O
Vì Fe2O3 không phản ứng được với dung dịch kiềm, nên cân nặng chất rắn còn lại là Fe2O3
mFe2O3 = 16 gam.
Từ kia tính được số mol của oxit fe III là: → n Fe2O3 = 16/160 = 0,1 mol
Tiến hành bội nghịch ứng sức nóng nhôm của X:
PTHH: Cr2O3 + 2Al → Al2O3 + 2Cr (1)
PTHH: Fe2O3 + 2Al → Al2O3 + 2Fe (2)
0,1 mol
Theo bài ra ta tất cả số mol Al bắt buộc phản ứng đang bằng: nAl = 10.8/27 = 0.4 (mol)
Theo phương trình (2) khi cân đối số mol thì nAl = 2.nFe3O4 = 0,2 (mol)
Do đó, số mol còn lại của Al tất cả trong phương trình (1) là:
nAl (1) = 0.4 – 0.2 = 0.2 (mol)
Dễ dàng suy ra:
nCr2O3 = 0.1 mol ——> m = 15.2 gam
Phần trăm oxit crom trong các thành phần hỗn hợp bằng: % Cr2O3 = 15.2 / 41.4 = 36.71 % —-> Chọn lời giải trắc nghiệm là D.
Bài số 2:
Đề bàiNung lạnh m gam các thành phần hỗn hợp Al cùng Fe2O3 (ở trong môi trường không tồn tại không khí) tới khi phản ứng xảy ra hoàn toàn, thu được tất cả hổn hợp rắn Y. Rồi phân tách Y thành nhị phần bằng nhau:
– Phần 1 cho tác dụng với hỗn hợp H2SO4 loãng (dư), hiện ra 3,08 lít khí H2 (ở đktc);
– Phần 2 cho tính năng với hỗn hợp bazo NaOH (dư), hình thành 0,84 lít khí H2 (ở đktc).
Giá trị của m là
22,75 21,40. 29,40. 29,43.Bài tập số 2
Lời giảiĐầu tiên ta xác định được ngay lập tức là dạng toán liên quan đến làm phản ứng nhiệt độ nhôm giữa Al và oxit sắt II. Phương trình phản nghịch ứng:
PTHH: 2Al + Fe2O3 —-> Al2O3 + 2Fe (1)
Phần 2 tác dụng với dung dịch bazo NaOH (dư), có mặt 0,84 lít khí H2 (ở đktc):
Al + NaOH + H2O NaAlO2 + 3/2H2
Phần (1) tác dụng với dung dịch H2SO4 ta được những phương trình sau:
PTHH: 2Al + 3H2SO4 ————-> Al2(SO4)3 + 3H2
=>nAl= 0.025(mol)
fe + H2SO4 l ——————-> FeSO4 + H2
y = 0.1 mol
2Al + Fe2O3 —————-> Al2O3 + 2Fe (1)
Khối lượng của Al : m (Al) = (0,1 +0,025).27 = 3,375(gam)
Khối lượng của Fe2O3 : m(Fe2O3) = 0,05.160 = 8(gam)
Suy ra tổng cân nặng của hóa học rắn: m = 11,375.2 = 22,75 (gam)
Vậy lời giải đúng của bài bác tập này là lời giải A. 22,75 gam
Vừa rồi chúng ta đã tìm hiểu phản ứng nhiệt độ nhôm là gì và cùng giải một trong những bài tập liên quan đến hiệu suất phản ứng nhiệt nhôm! hy vọng những thông tin trên sẽ giúp đỡ ích cho các bạn học tốt hơn về bộ môn hóa học! Hẹn chạm chán lại các bạn trong các nội dung bài viết tiếp theo của quartetpress.com!















